
Martin Knudsen (University of Copenhagen, Denmark)
Teoria cinetica / 2
Come combattere l'inquinamento dell'aria. La fisica aiuta
Che cosa fanno le particelle nel gas che le ospita. Per spiegarlo bisogna ricorrere al danese Knudsen, che ha gettato un ponte fra i due mondi
Sabato 7 gennaio vi ho parlato della fisica dell’aerosol, delle sue basi nella teoria cinetica dei gas e di come sia importante, nella vita quotidiana e anche come guida in alcune delle scelte cruciali per l’umanità oggi. Vi chiederete: ma è possibile fare della divulgazione scientifica rigorosa, non una semplice informazione scientifica, su un quotidiano? Impresa ardua, quasi impossibile. L’impossibile mi attira, quindi da “testone” (i reggiani sono noti per essere “testoni”, testardi) provo a continuare. Prendiamola come un gioco, senza fare uso di formule matematiche. Ma ne vale la pena perché il gioco ci aiuta ad avere opinioni meditate e sicure su un sacco di problemi, senza andare a rimorchio di fake news e pensieri unici, ora dilaganti. Un po’ di concentrazione è necessaria ma molto meno di quella che deve avere un giocatore di scacchi, anche solo principiante.
Abbiamo detto che con un’unica parola “aerosol”, intendiamo due cose insieme: la particella solida (o gocciolina liquida) e il gas (quasi sempre aria) che la ospita. La particella che dimensioni può avere, restando sospesa nel gas senza cadere rapidamente? Per rispondere mettiamo a fianco una formica (tipicamente grande un millimetro) e una mongolfiera (tipicamente 10 metri). Quattro ordini di grandezza in dimensione; quanti oggetti hanno dimensione fra i due! Per le particelle sospese è la stessa cosa: variano in dimensione per quattro ordini di grandezza, e possono avere forme diversissime e densità pure diversissime. Per non parlare della loro composizione chimica, che può essere la più varia. Anche per la forma sono diversissime. Quando la forma si allontana dalla sfera (possono presentarsi come esilissime catene, o fibre, o essere cave, o porose, al microscopio elettronico) noi dobbiamo scegliere una dimensione convenzionale d, che per la sfera coincide ovviamente col suo diametro.
E del gas cosa possiamo dire? La teoria cinetica ci dice che, anche se non li vediamo, il gas è fatto di tanti oggettini, le molecole, che si muovono come pazze, e la loro pazzia è misurata, macroscopicamente, dalla temperatura. Più questa è alta più loro sono pazze, e viceversa. Per misurare la loro pazzia c’è un sistema molto semplice. Pensiamo che se si agitano devono anche urtarsi fra loro, quindi immaginiamo (ho detto che è la prima vera teoria in fisica, solo prodotto del pensiero, niente di sperimentale per ora) di mettere tutte le distanze fra un urto e l’altro in una scatola mentale e calcolare la loro media. Chiamiamo questa distanza media “cammino libero medio” delle molecole, e lo indichiamo con la lettera l.
Ma come trovare un terreno comune fra i due ambiti, che li descriva come un sistema unico, qualcosa che leghi la particella al gas che la ospita, la lettera l alla lettera d? E’ semplice, prendiamo il loro rapporto: l/d. Abbiamo riscoperto il numero di Knudsen Nkn = l/d. Il signor Knudsen, danese (1871-1949) ha il merito di avere gettato questo ponte fra i due mondi. Per intenderci, quando la particella è piccolissima rispetto al cammino libero medio delle molecole Nkn va all’infinito, e invece quando è grande Nkn va a zero. Più praticamente, nel gergo nostro parliamo di tre regimi importanti di questo numero: regime “molecolare” quando Nkn è maggiore di uno, regime “viscoso” ( o “del continuo”) quando Nkn è piccolo, minore di 0,01, infine regime di transizione quando Nkn ha un valore intermedio fra i due. Un bell’esempio di applicazione del numero di Knudsen lo possiamo avere dal diverso meccanismo di resistenza che la particella incontra quando deve muoversi per qualche forza esterna (gravità, campo elettrico, la stessa forza termoforetica già introdotta), entro il gas. Anche qui ci serviamo di un disegnino.
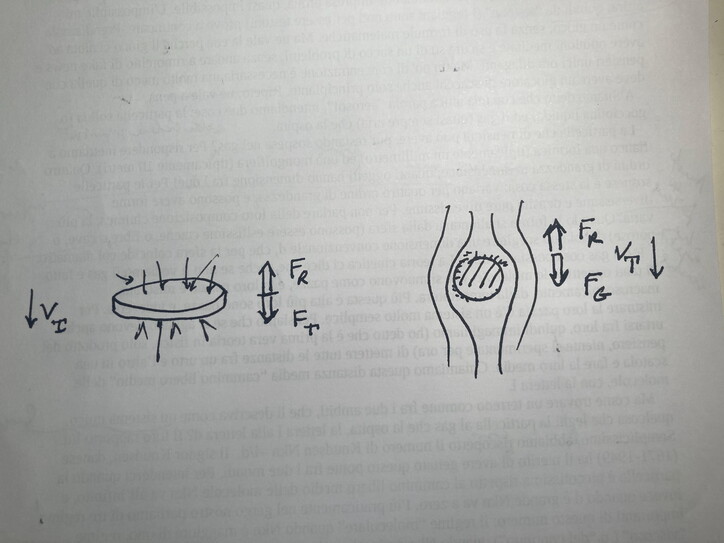
Nella parte a sinistra immaginiamo la particella, piccolissima, come un disco che cade, nella parte a destra rappresentiamo una particella molto più grande, che subisce un numero enorme di urti, tanto che la possiamo pensare come una sferetta di acciaio che cade nel miele. Nel primo caso la resistenza è causata dal maggiore scambio di quantità di moto sul fronte che non sul retro. Gli urti di fronte saranno più “forti” degli urti sul retro. Ricordiamo che sta cadendo alla sua velocità terminale. E’ facile immaginare che in questo caso la resistenza sarà proporzionale alla sezione che la particelle presenta al suo moto. Nel secondo caso il numero di urti è talmente alto che il gas è come fosse un continuo; è tutto il fluido che si avvolge intorno alla sferetta e la resistenza è viscosa (legge di Stokes, per chi se la ricorda…). Fra le due ci sono tutte le situazioni intermedie, regolate dal nostro Nkn. E questo vi fa capire che si tratta di una fisica complicata anche se rimaniamo sempre nel campo classico.
Il passo che abbiamo fatto, di capire come si manifesta la forza di resistenza, è importante. Già abbiamo visto che questa forza può equilibrare la forza termoforetica per dare una velocità costante alla particella. Stiamo parlando di una fisica che deve risolvere problemi veri, che entrano nella vita di tutti. L’inquinamento dell’aria sappiamo che statisticamente porta ad accorciare l’aspettativa di vita. Per ridurre l’inquinamento da particelle dobbiamo “estrarre” la particella dalla sua matrice gassosa, separare insomma la particella dal gas che la ospita. E questo lo si può fare solo sfruttando i processi fisici e le forze che andiamo descrivendo. Senza volere, stiamo svolgendo proprio questo tema: come possiamo rimuovere le particelle dal loro gas (aria). Voi direte che ci sono già sistemi di abbattimento in ogni processo industriale che comporti emissioni in atmosfera. Ma non sono sistemi efficienti al 100 per cento. Vedi dibattito sugli inceneritori (o termovalorizzatori) così attuale. C’è ampio margine di miglioramento e questo è un campo affascinante di ricerca. Che ci porta a un miglioramento della nostra vita. Diciamo che combattere l’inquinamento da particolato dell’aria vorrà dire tirare fuori le particelle dal loro gas e portarle in discarica in qualche modo prima che arrivino alle nostre vie respiratorie, e fare questo significa sfruttare le forze che possiamo avere in gioco e che abbiamo cominciato a descrivere e riprenderemo in alcuni prossimi appuntamenti.
Ma ora che avete fatto lo sforzo meritate un premio, alleggeriamo la concentrazione mentale per portarci alla letteratura, al bello scrivere anche sempre parlando di fisica. Pensiamo alla bellezza della prosa di Galileo, che è sempre più apprezzata nella letteratura italiana, agli elogi che ne fa Italo Calvino. Alcuni scienziati, quando sono consapevoli di dare una svolta importante al pensiero dell’umanità, nella loro prosa raggiungono i vertici anche della bellezza artistica. Facciamo un breve percorso inverso a quello di Goethe, che con la sua “Teoria dei colori ” (Tubinga, 1810) si lanciava in un lavoro scientifico, in contrapposizione a Newton e pensava che la scienza uscisse più dalla poesia e che non vi fosse incompatibilità fra arte e scienza.
Questo pistolotto per portarci a quello che sarà il prossimo argomento, il moto browniano, e ci avviciniamo per questo al grande Jean Perrin (Nobel per la Fisica, 1926), e alla sua bellissima prosa in Les atomes (1913), che riporto ora nel punto dal quale ci siamo mossi, tra l’invisibile dell’agitazione delle molecole scrutate col solo pensiero, e il visibile delle particelle: “L’agitazione molecolare sfugge alla nostra percezione diretta come il movimento delle onde del mare sfugge a un osservatore troppo lontano. Ciononostante se qualche battello si trova in quel momento in vista, quel medesimo osservatore potrà vedere un ondeggiamento che gli rivelerà l’agitazione che egli non supponeva. Allo stesso modo non si può allora congetturare che se delle particelle microscopiche si trovino in un fluido, e sufficientemente grandi da essere seguite col microscopio siano tuttavia sufficientemente piccole da essere notevolmente agitate dagli urti molecolari?”. Questa magnifica prosa apre la mente nel confronto onde-molecole e battello-particella pone Perrin in quel momento dalla parte di Goethe con la poesia che emerge nel descrivere il fenomeno. Alla prossima. Al moto browniano ed al suo ruolo nella fisica dell’aerosol.
Potete trovare la prima parte della spiegazione a questo link.





